| 教員の研究 |
 |
|
| 詳しいプロフィール・業績等はこちらの研究者情報をご覧ください。 |
| 研究室のホームページもご覧ください。 |
|
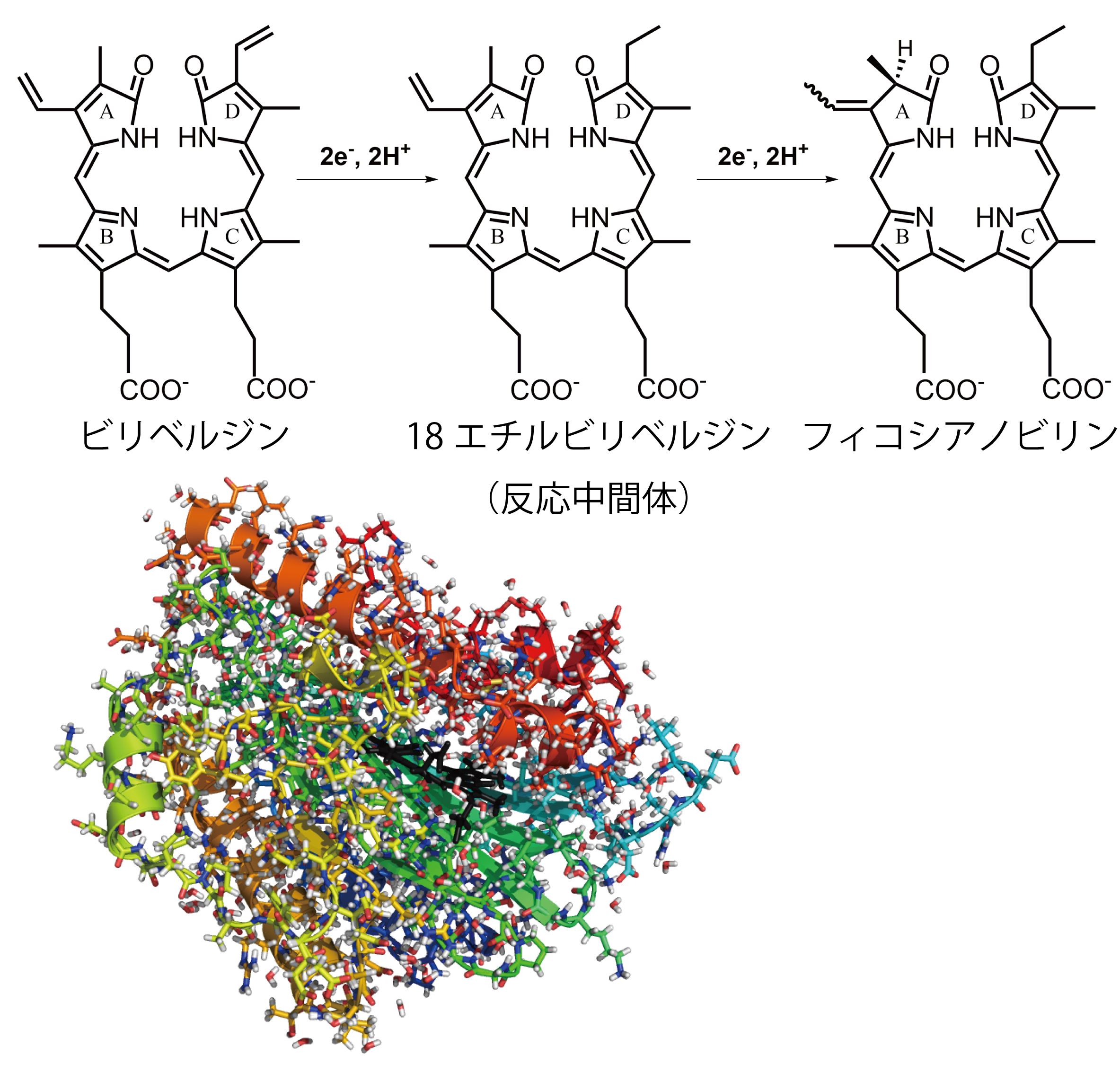
内容:我々、人間やその他の全ての生物のからだの構成成分で水の次に多いのは、蛋白質です。蛋白質は、様々な役割を担っています。例えば、酸素を運ぶ蛋白質、古くなった蛋白質を分解する蛋白質、細胞の構造を維持する蛋白質、信号を送ったり受けたりする蛋白質等々・・・・例を挙げればきりがないほどです。それらの蛋白質は、なぜ、そのような役割を担うことができるのでしょうか。その答えを解明する一つの手段として、それぞれの蛋白質分子の中の原子の立体配置を明らかにして、立体化学の観点で捉える方法です。 現在、私達の研究室では、1. 毛髪内で金属の濃度の恒常性維持を担っている蛋白質群、2. 光合成生物の中で、光合成や光応答反応に使われる「色素」を合成している蛋白質、などの研究を中心に行っています。前者はそれらの蛋白質達がどう相互作用しているのか、相互作用相手を識別していのか、機能を発揮しているのか、ということを、構造を解明することで明らかにしようとしています(図1)。複合体の結晶を作り、X線を照射して、構造を明らかにしたいと思っています。後者は、水素原子が関与する酵素ですので、水素原子を目で見ようと頑張っています(図2)。X線では水素原子を見ることが非常に難しいので、X線だけでなく中性子やその他の手法を使って細かく調べていきます。その他、興味深い蛋白質がたくさんあり、メンバーが増えていけば、テーマも広がっていきます。 これらは「生命の神秘を解き明かす」基礎研究ですが、新規薬剤の開発や病気の治療法の開発などにつながる基礎となるデータを提供することで人類に貢献します。 |